MDD医疗设备认证
华讯检测 2019-7-1医疗器械认证93/42/EEC 认证流程及更新至MDR新指令变动
1:什么是93/42/EEC医疗器械指令?
指令包括了医疗设备以及它的配件
根据指令医疗器械设备意味着:
任何仪器、器具、设备、材料及其它物品,无论是单独使用还是组合使用,如需要包括软件等;只要设备其是针对人体具备以下一些目的的前提下:
诊断、预防、监测、治疗或缓解疾病,
诊断、监测、治疗、缓解或补偿受伤或残疾,
调查,更换或修改解剖或生理过程的,
受孕控制,
2:如何定义产品分类
医疗设备分有不同的类别等级根据医疗设备指令指导性文件(MEDDEV 2.4)并且每个指令有一个规则(Rule)
Class I other 一类其他
Class I sterile 一类灭菌
Class I measurement function 一类测量
Class IIa 2a类
Class IIb 2b类
Class III and Class III with medicine 三类及三类带药物
3:如何定义产品分类
首先产品的规则是确定的
其次规则显示了产品的等级分类
第三符合性评估的模式是被选择的
4:认证流程
所有的符合性评估都始于以下:
1) 收到申请表
2) 签署合同
3) 计划审厂
4) 实施审厂
5) 签发证书 / 重审核 /等待NC不符项关项
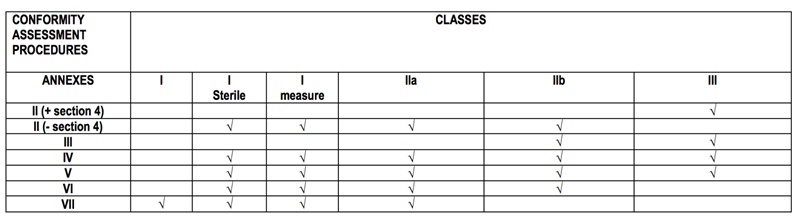
5:符合性评估程序
分类依据MDD指令附录九
2. 选择一个符合性评估程序
3. 公告机构执行符合性评估
(提申请, 审核技术文件, 现场审核等等)
4. 公告机构签发证书 (证书有效期5年)
5. 年审
(初次审核之后的1年一定要进行年审.)
(公告机构每三年一次突击审核,时间可以更短.)
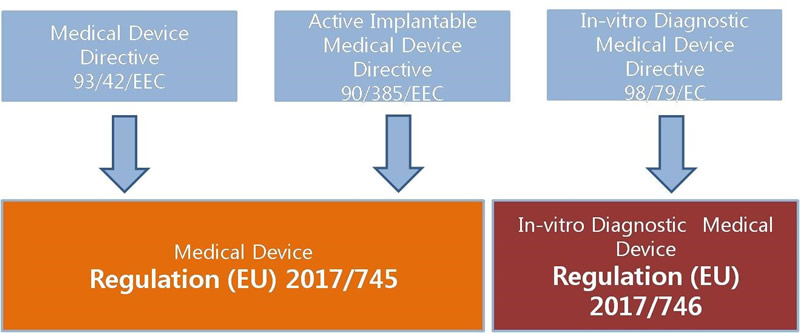
6:MDR申请(章节 3.1 – 段落 1)
拟定的新法规很大程度上扩展涵盖了90/384/EEC指令以及93/42/EEC指令;例如 :它包括了所有除了体外诊断设备的医疗器械。
另外,除此之外,范围还扩展包括了一些现有指令AIMDD/MDD没有包含的产品。还有一些产品是在一些成员国被认为是医疗器械却不在指令范围内的。
7:MDR申请
扩展的范围主要包括了:
制造采用非可行的人体组织或细胞的产品,或其衍生物,已经发生了实质性的操作(例如注射器预装与人体胶原蛋白),除非他们被法规(EC)1394 / 2007上先进的治疗药用产品所涵盖。
人体组织和细胞,或产品来自人体组织或细胞,基本上没有操纵,受指令2004/23/EC欧盟议会和2004年3月31日制定质量标准和安全的捐赠、采购、检验、加工、保存委员会、人体组织和细胞存储和分布不受该方案管控
某些植入式或其他侵入式的产品没有医疗的目的却类似于医疗设备的特点和风险状况(例如非矫正性隐形眼镜,美瞳)
8:MDR 定义
医疗设备’ 意味着任何仪器、器械、软件、植入品、试剂、材料或其他物件,无论单独使用还是组合使用;制造使用目的是:对人体产生一种或多种医疗目标诸如:
–诊断、预防、监测、治疗或缓解疾病
–诊断、监测、治疗、缓解或补偿受伤或残疾
–调查,更换或修改的解剖或生理过程或状态
–受孕支持或者控制
–任何上述产品消毒或灭菌
9:变更时间
4.png
10:分类规则
分类规则
Rule 1~4 非侵入性设备
Rule 5~8 侵入性设备
Rule 9~12 有源设备
Rule 12~18 特殊规则
变更
Rule 3 – 受孕支持
Rule 6 – 去除可重复使用手术器械
Rule 8 –AIMD增加一些包含在AIMD指令下产品
Rule 9 – AIMD指令内容的增加
Rule 16 增加词汇“核磁共振、超声波”
Rule 17 – 人体源或动物源设备
Rule 19~21 – 新规则
1:什么是93/42/EEC医疗器械指令?
指令包括了医疗设备以及它的配件
根据指令医疗器械设备意味着:
任何仪器、器具、设备、材料及其它物品,无论是单独使用还是组合使用,如需要包括软件等;只要设备其是针对人体具备以下一些目的的前提下:
诊断、预防、监测、治疗或缓解疾病,
诊断、监测、治疗、缓解或补偿受伤或残疾,
调查,更换或修改解剖或生理过程的,
受孕控制,
2:如何定义产品分类
医疗设备分有不同的类别等级根据医疗设备指令指导性文件(MEDDEV 2.4)并且每个指令有一个规则(Rule)
Class I other 一类其他
Class I sterile 一类灭菌
Class I measurement function 一类测量
Class IIa 2a类
Class IIb 2b类
Class III and Class III with medicine 三类及三类带药物
3:如何定义产品分类
首先产品的规则是确定的
其次规则显示了产品的等级分类
第三符合性评估的模式是被选择的

4:认证流程
所有的符合性评估都始于以下:
1) 收到申请表
2) 签署合同
3) 计划审厂
4) 实施审厂
5) 签发证书 / 重审核 /等待NC不符项关项
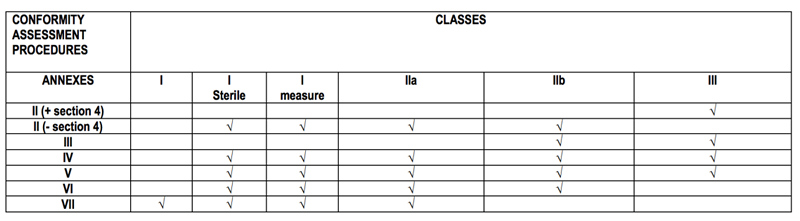
5:符合性评估程序
分类依据MDD指令附录九
2. 选择一个符合性评估程序
3. 公告机构执行符合性评估
(提申请, 审核技术文件, 现场审核等等)
4. 公告机构签发证书 (证书有效期5年)
5. 年审
(初次审核之后的1年一定要进行年审.)
(公告机构每三年一次突击审核,时间可以更短.)

6:MDR申请(章节 3.1 – 段落 1)
拟定的新法规很大程度上扩展涵盖了90/384/EEC指令以及93/42/EEC指令;例如 :它包括了所有除了体外诊断设备的医疗器械。
另外,除此之外,范围还扩展包括了一些现有指令AIMDD/MDD没有包含的产品。还有一些产品是在一些成员国被认为是医疗器械却不在指令范围内的。

7:MDR申请
扩展的范围主要包括了:
制造采用非可行的人体组织或细胞的产品,或其衍生物,已经发生了实质性的操作(例如注射器预装与人体胶原蛋白),除非他们被法规(EC)1394 / 2007上先进的治疗药用产品所涵盖。
人体组织和细胞,或产品来自人体组织或细胞,基本上没有操纵,受指令2004/23/EC欧盟议会和2004年3月31日制定质量标准和安全的捐赠、采购、检验、加工、保存委员会、人体组织和细胞存储和分布不受该方案管控
某些植入式或其他侵入式的产品没有医疗的目的却类似于医疗设备的特点和风险状况(例如非矫正性隐形眼镜,美瞳)
8:MDR 定义
医疗设备’ 意味着任何仪器、器械、软件、植入品、试剂、材料或其他物件,无论单独使用还是组合使用;制造使用目的是:对人体产生一种或多种医疗目标诸如:
–诊断、预防、监测、治疗或缓解疾病
–诊断、监测、治疗、缓解或补偿受伤或残疾
–调查,更换或修改的解剖或生理过程或状态
–受孕支持或者控制
–任何上述产品消毒或灭菌
9:变更时间
4.png
10:分类规则
分类规则
Rule 1~4 非侵入性设备
Rule 5~8 侵入性设备
Rule 9~12 有源设备
Rule 12~18 特殊规则
变更
Rule 3 – 受孕支持
Rule 6 – 去除可重复使用手术器械
Rule 8 –AIMD增加一些包含在AIMD指令下产品
Rule 9 – AIMD指令内容的增加
Rule 16 增加词汇“核磁共振、超声波”
Rule 17 – 人体源或动物源设备
Rule 19~21 – 新规则

